De tout temps, l’homme s’est interrogé sur la nature et la diversité de la matière. Il y a plus de 2 500 ans, des philosophes grecs postulaient que celle-ci était constituée d’entités élémentaires et indivisibles : les atomes.

Pourtant, avec Aristote, une autre vision s’imposa, fondée sur quatre éléments le feu, l’air, la terre et l’eau. Cette théorie, bien qu’inexacte, domina la pensée scientifique pendant plus de deux millénaires, servant d’ailleurs de fondement à l’alchimie médiévale.
À partir du XVIIIe siècle, de grands scientifiques jetèrent les bases expérimentales de la chimie moderne, notamment Antoine Lavoisier (1743–1794) en France. En Angleterre, John Dalton formule en 1803 sa théorie atomique, une avancée majeure : chaque élément chimique est constitué d’atomes uniques et caractéristiques, distincts de ceux des autres substances.
Les corps simples
Un corps simple est une substance constituée d’un seul type d’atome. Dès l’antiquité on en connaît une dizaine, comme le fer, le soufre, le plomb ou l’or.
C’est Lavoisier qui, dans son Traité élémentaire de chimie (1789), formalisa cette notion. Il y établit une liste de substances indécomposables — des éléments impossibles à diviser par les moyens expérimentaux de l’époque. À la fin du XVIIIe siècle, on en dénombrait une vingtaine et ce nombre n’a cessé depuis d’augmenter.
Ces corps simples, associés entre eux sous forme d’une multitude de molécules différentes, constituent l’intégralité de notre univers. Pour cataloguer les listes de ces corps simples, un défi s’imposa : les organiser de manière scientifique, afin d’en révéler les propriétés et les liens.
La masse atomique
Avant le XXe siècle, mesurer le poids d’un atome était impossible, mais on savait comparer les poids de deux corps simples entre eux. Le billet Avogadro montre que deux volumes égaux de gaz différents, à même température et même pression, contiennent le même nombre d’atomes. Par conséquent si l’un des volumes est deux fois plus lourd que l’autre, on saura que son poids atomique est le double de l’autre. On emploi ici le terme de poids atomique, ce qu’on pèse. De façon plus universelle on emploiera maintenant le terme de masse atomique.
Peu à peu, à partir des travaux de John Dalton (1803), et grâce à de multiples expériences minutieuses, les chimistes déterminent les masses atomiques en comparaison de celle de l’hydrogène, la plus légère connue, fixée par convention à 1. On trouve par exemple 12 pour le Carbone, 16 pour l’Oxygène, 32 pour le soufre…
On sait interpréter aujourd’hui ces multiples. Un atome est composé d’un noyau lourd de nucléons (des protons et des neutrons de masse très voisine) entourés d’électrons de masse négligeable ici. L’atome d’hydrogène ne comporte qu’un seul nucléon, tandis que celui du carbone en comporte 12, celui de l’oxygène 16 et ainsi de suite.
Nous voilà, au milieu du XIXe siècle, avec une soixantaine de corps simples identifiés, qui se caractérisent par des masses atomiques et des propriétés chimiques différentes.
Dmitri Mendeleïev et la naissance du tableau périodique
En classant les éléments par masse atomique croissante, les chimistes remarquent une étrange périodicité : certaines propriétés chimiques semblent se répéter à intervalles réguliers, conduisant aux premières tentatives de classification. Bien qu’ingénieuses, elles restent cependant incomplètes.

C’est alors qu’intervient Mendeleïev, scientifique visionnaire. En 1869, il présente une solution révolutionnaire : le tableau périodique des éléments. Son approche est aussi simple que géniale. Il parvient à classer les 63 éléments connus à l’époque par masse atomique croissante, à la fois horizontalement et verticalement, de façon que des éléments qui partagent des propriétés chimiques similaires soient alignés. Et si dans son tableau apparaissent des cases vides (?) , Mendeleïev prédira qu’elles correspondent à des éléments inconnus à l’époque, une certitude qui sera confirmée par la découverte ultérieure du gallium, du scandium par exemple.
Ainsi, Mendeleïev ne se contente pas de classer les éléments . Il invente un tableau universel, toujours utilisé aujourd’hui, et ouvre la voie à la compréhension moderne de la matière.
Le Tableau périodique des éléments actuel
Le tableau de Mendeleïev sera complété peu à peu au fil des décennies, 118 éléments actuellement, dont 94 éléments naturels existants sur terre, les autres étant artificiels. Mais il sera surtout modifié substantiellement par la découverte du proton.
De façon imagée et simplifiée, l’atome est constitué d’un noyau composé de protons et de neutrons, autour duquel gravitent des électrons sur plusieurs orbites spécifiques, au nombre maximum de 7. La disposition des électrons influence sa capacité à se lier ou non à d’autres atomes, et donc ses propriétés chimiques.
Dans un atome neutre, les protons étant dotés d’une charge positive et les électrons d’une charge négative équivalente, ils sont en nombre égal, appelé « numéro atomique ». On comprend alors que c’est lui, donc le nombre de protons (et d’électrons), qui en réalité gouverne les propriétés chimiques des éléments, plutôt que leur masse atomique.
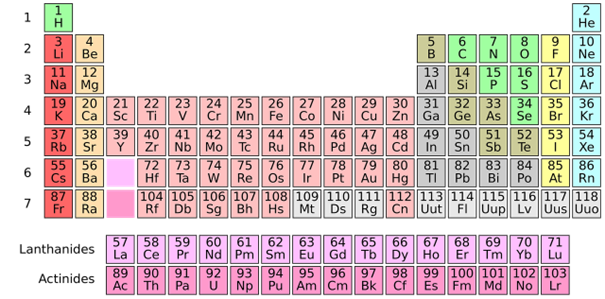
Dans le tableau périodique actuel ci-dessus, les éléments sont maintenant classés par numéro atomique, qui prend toutes les valeurs successives de 1 (l’hydrogène a un proton), 2 (Hélium), 3 (Lithium) etc… jusqu’à 118, correspondant à l’Organesson, dernier élément découvert récemment. Les 7 lignes correspondent aux 7 couches électroniques possibles. Les colonnes indiquent des groupes d’éléments aux propriétés chimiques semblables. Par exemple la dernière colonne comprend les « gaz rares » – hélium, néon, argon … – dont la dernière couche d’électrons est saturée, d’où leur inertie chimique.
Une question se pose bien sûr : y a-t-il des éléments à découvrir au-delà du 118e ? On ne connaît pas le nombre maximum de protons qu’un atome peut contenir. Les scientifiques estiment qu’au-delà de 130, la stabilité des noyaux atomiques empêcherait l’existence d’atomes superlourds. On continue la recherche…
–oo—oo–