Quand s’achève le 19e siècle, les physiciens, qui pensaient avoir une conception claire et quasi-aboutie de leur science, vont être confrontés à plusieurs découvertes majeures, comme la relativité et la physique quantique. Elles vont complétement bouleverser leur vision de l’univers.
Le rayonnement d’un corps chauffé
Tout corps émet un rayonnement thermique, quelle que soit sa température. L’énergie thermique contenue dans le corps (on sait que c’est la plus ou moins grande vibration de ses atomes), est émise sous forme de rayonnement électromagnétique (1), c’est-à-dire de lumière. Suivant sa longueur d’onde, elle est non visible (lumière infra-rouge ou ultra-violette), ou visible (couleurs de l’arc-en-ciel).

Au-delà d’environ 500°C, le rayonnement donne de la lumière visible dont la couleur dominante varie à mesure que la température croît : rouge, orange, jaune jusqu’au blanc bleuté.
Depuis l’antiquité, les potiers et les forgerons avaient remarqué qu’à une température donnée dans leur four ou leur forge correspondait une couleur spécifique, quelle que soit la matière chauffée. C’est d’ailleurs ce qui leur permettait de vérifier la température, par exemple rouge cerise vers 750°C. Le fait que la matière chauffée n’ait aucune incidence sur la couleur du rayonnement était déjà intriguant et remarquable.
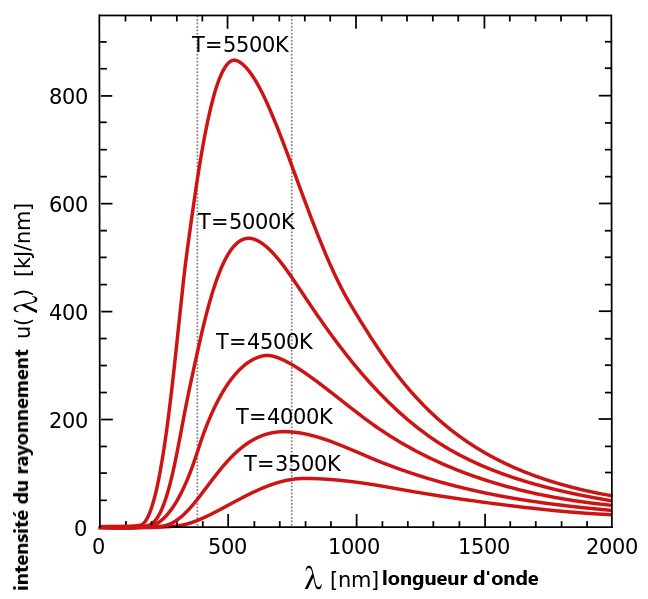
Plus généralement, pour une température donnée, le rayonnement émis couvre tout un spectre de longueurs d’onde (courbe en cloche ci-contre) dont le maximum correspond à une couleur et une intensité spécifiques, qui ne dépendent, comme on l’a vu, que de la température. On retrouve là la couleur de température dominante observée par les potiers. De part et d’autre de ce maximum rayonnent d’autres longueurs d’ondes d’intensité décroissantes.
La physique de l’époque ne permettait pas d’expliquer ces courbes, et les physiciens cherchaient activement une loi donnant les caractéristiques de ces spectres d’émission en fonction de la température, pressentant qu’il y avait là un défi théorique fondamental. Plusieurs lois approximatives avaient été élaborées, mais leurs résultats ne cadraient pas bien avec la réalité.
Le physicien allemand Max Planck s’était emparé de ce sujet complexe, et fut le premier à formuler génialement en 1900 une loi complète, empirique, parfaitement en accord avec les mesures expérimentales et les courbes affichées ci-dessus.
Cette loi introduisait cependant une notion toute nouvelle de quantification de l’énergie, avec la constante dite de Planck, les échanges d’énergie entre la matière et la lumière ne pouvant se faire que par petits paquets, par quanta. A noter qu’à l’époque Planck ne croyait pas aux théories atomistes naissantes, et comme beaucoup de physiciens croyait à la continuité des phénomènes physiques. Il n’avait fait qu’à contre-cœur l’hypothèse de ces quanta.
Mais voilà qu’Einstein vient confirmer l’existence des quanta de façon spectaculaire.
Effet photoélectrique
Une expérience montrait qu’en bombardant un feuille métallique avec un rayon lumineux, des électrons étaient éjectés de la feuille. C’est l’effet photoélectrique : de la lumière éjecte des électrons récupérés en un courant électrique. On s’attendait à ce que ces électrons soient d’autant plus énergétiques, et le courant électrique aussi, que le rayon lumineux était puissant. Mais en fait on constatait que l’énergie des électrons était totalement indépendante de l’intensité de la lumière.
Albert Einstein fut le premier à proposer une explication, en utilisant justement le concept de particule de lumière ou quantum, appelé aujourd’hui photon.
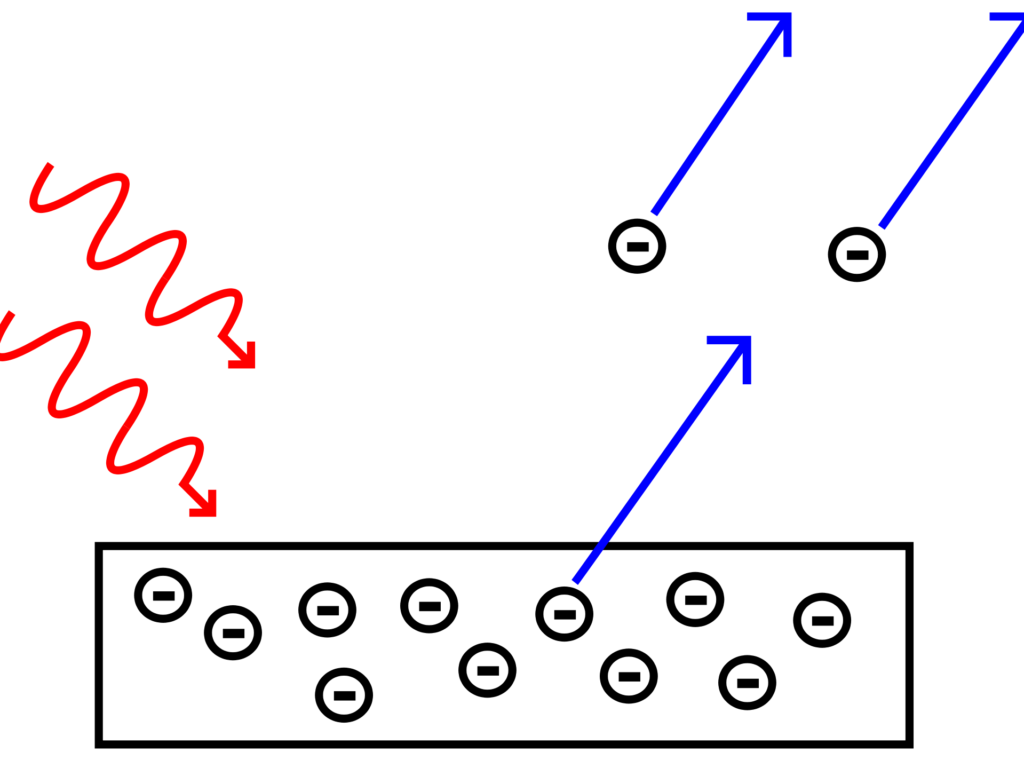
Il expliqua que l’effet photoélectrique était provoqué par l’absorption de photons, des quanta de lumière, lors de l’interaction du matériau avec la lumière. Les photons de la source lumineuse possèdent chacun une énergie caractéristique déterminée par la fréquence de la lumière, sa couleur. Lorsqu’un électron du matériau absorbe un photon et que l’énergie de celui-ci est suffisante, l’électron est éjecté; sinon l’électron ne peut s’échapper du matériau.
En augmentant l’intensité de la source lumineuse on n’augmente pas l’énergie des photons mais seulement leur nombre. Pour augmenter l’énergie des photons, il faut modifier la fréquence de la lumière, sa couleur. On comprend dès lors que l’énergie des électrons émis par le matériau dépend de la fréquence du rayonnement (sa couleur), et pas de son intensité.
Les quanta
Voilà la compréhension de la loi de Planck : les atomes de la matière émettent de l’énergie sous forme d’un rayonnement électromagnétique, de la lumière. L’émission d’énergie ne se fait pas de façon continue, mais par paquets ou quantités d’énergie minimale, les quanta ou photons. Voilà ce dont est composée la lumière.
Les quanta permettront de comprendre le fonctionnement de l’atome, voir ce billet (2). Auparavant, allons voir de plus près ce qu’est la lumière : un flot de photons ou une onde ?
–oo–oo–
- Voir le billet Électromagnétisme 2 – Partout des ondes électromagnétiques
- Voir le billet Physique quantique 3 – L’atome expliqué