Début 20e siècle émerge peu à peu la connaissance de l’atome, formé d’un noyau de très petite taille et d’un cortège d’électrons en orbite, dont on ne comprenait pas pourquoi ils restaient sur des orbites stables.
On a vu dans un billet précédent (1) l’apparition de la notion de quanta, ou de photon. Niels Bohr en tirera la solution en 1913.
Le modèle de Niels Bohr complété par Louis de Broglie
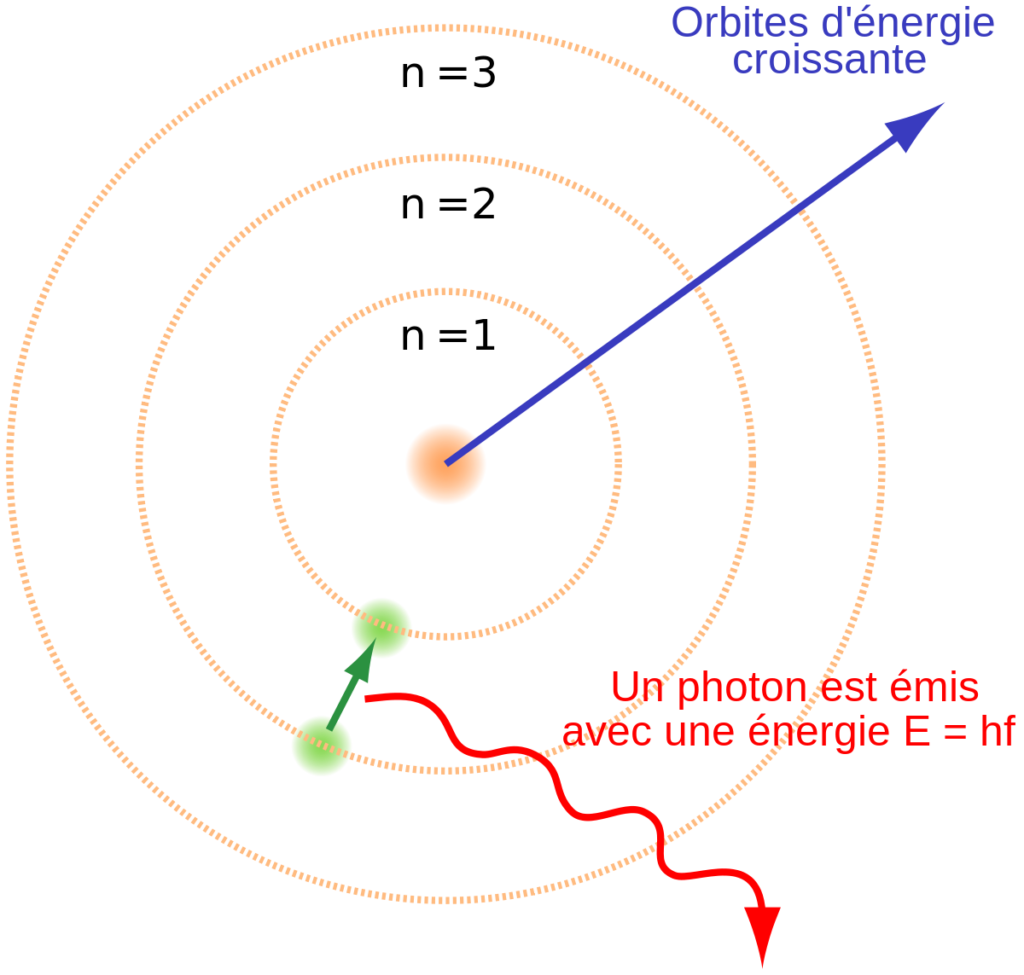
Dans le modèle de Bohr, les électrons sont regroupés par couches et organisés en orbites stables et définies, chacune correspondant à un niveau d’énergie quantifiée. A noter qu’au-delà du schéma ci-dessous, un atome peut comporter jusqu’à 7 couches et une centaine d’électrons. Lorsqu’un électron reçoit un quantum d’énergie adéquat (un photon), il l’absorbe et saute d’une orbite à une autre. Inversement, il retombe d’une orbite à une autre en émettant un photon.
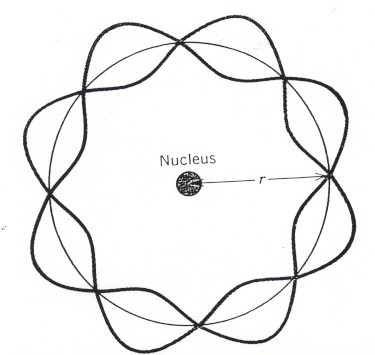
On a vu par ailleurs dans le billet précédent que l’électron, comme toutes les particules, a un comportement onde-corpuscule. Louis de Broglie complète le modèle de Bohr avec cette notion ondulatoire, en montrant que le périmètre de chaque orbite correspond à une nombre entier de longueurs d’onde de l’électron. Les différentes couches électroniques correspondent à un nombre croissant de cette longueur d’onde.
L’image classique d’un électron « particule » orbitant autour du noyau est dès lors abandonnée, au profit d’un électron « onde-corpuscule », associé à une longueur d’onde donnée.
Des « orbites vibrantes »
Dans mon carnet, je me représente ces électrons non pas comme des corpuscules, mais comme des « orbites vibrantes »…
Lorsqu’une orbite vibrante reçoit un photon d’énergie adéquate, elle l’absorbe et augmente sa taille d’une ou plusieurs longueurs d’onde, à condition donc que l’énergie apportée corresponde exactement à ces longueurs d’onde supplémentaires.
Inversement cette orbite vibrante peut, spontanément ou non, diminuer sa taille d’une ou plusieurs longueur d’onde, en émettant un photon lumineux d’énergie précise, donc de fréquence ou couleur déterminée (2).
C’est ainsi que la matière chauffée dans un four par exemple absorbe de l’énergie, et inversement la rediffuse sous forme de lumière, visible ou non.
Spectroscopie
L’absorption ou la rediffusion d’énergie lumineuse par de la matière n’est donc possible que pour certaines valeurs d’énergie, propre à cette matière.

On a établi pour chaque type d’atome la liste de ces valeurs spécifiques, correspondants aux raies d’un spectre caractéristique de l’atome. A l’aide d’un appareil appelé spectroscope, on décompose le flux d’émission ou d’absorption lumineuse par un corps, qui montre des raies spectrales caractéristiques. Sur l’image ci-contre, elles sont comparées avec un spectre continu de lumière blanche telle que décomposée par un prisme. En étudiant les raies spectrales de la lumière d’une étoile, ou de tout autre corps, on peut ainsi connaître précisément sa composition.
–oo—oo–
- Voir le billet Physique quantique 1 – au commencement, les quanta
- L’énergie du photon et sa fréquence sont liées par la formule E = h . ν = h . c / λ
où h est la constante de Planck, ν (nu) la fréquence de l’onde, λ sa longueur d’onde et c la vitesse de la lumière.